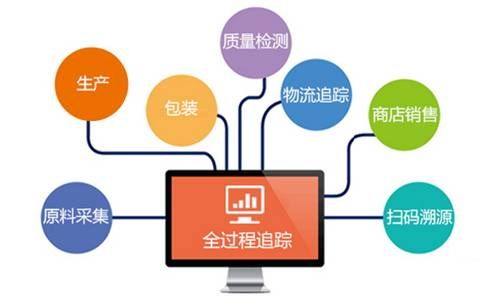
药品追溯体系的建立进入新阶段。为破解此前药品编码标准混乱难题,国家药监局11月1日下发的《国家药监局关于药品信息化追溯体系建设的指导意见》明确,由国家药监局负责规划确立药品信息化追溯标准体系,统一药品追溯编码要求。不过,统一标准、引入第三方看似一针见血,药企成本、数据安全却成新的“拦路虎”。药品追溯体系落地实操仍待攻坚。
统一标准
《国家药监局关于药品信息化追溯体系建设的指导意见》(以下简称《指导意见》)强调,要求实现药品信息化追溯数据社会公众可自主查验,提升全社会对药品信息化追溯的认知度。这也就意味着,一旦落地,类似问题疫苗的流向将不再无迹可寻。
《指导意见》表示,药品追溯各相关方应从制度上、技术上保证药品追溯数据真实、准确、完整、不可篡改和可追溯。药品追溯数据记录和凭证保存期限应不少于五年。
具体来看,《指导意见》强调,药品上市许可持有人和生产企业、批发企业、零售等每个环节都应向下游企业或医疗机构提供相关追溯信息。药品上市许可持有人和生产企业要能及时、准确获得所生产药品的流通、使用等全过程信息。保证从药品的研发生产、再到销售,每一个环节都实现追踪与确责。
缺乏统一的追溯标准是此前药品追溯监管中的一大难题。原国家食药监局于2016年9月颁布了《关于推动食品药品生产经营者完善追溯体系的意见》,明确表示,食品药品生产经营者应当承担起食品药品追溯体系建设的主体责任,鼓励各地组织和企业自建追溯系统,或者采购第三方信息技术企业的药品追溯服务。
但上述意见里却并未明确统一的追溯系统标准,这也让药企生产过程以及流通过程存在很大的监管漏洞。备受关注的长春长生疫苗事件调查结果足已显现,“企业编造生产记录和产品检验记录,随意变更工艺参数和设备”。
此次,《指导意见》明确,编制统一信息化追溯标准。结合药品信息化追溯体系建设实际需要,国家药品监督管理局规划确立药品信息化追溯标准体系,明确基本要求,发布追溯体系建设指南、统一药品追溯编码要求、数据及交换标准。
引入第三方
实际上,国内的药品追溯体系并非首次建立。早在2005年原国家食药监总局就与中信二十一世纪科技有限公司合作,开始建设中国药品电子监管平台。当时使用的药品电子监管码管理系统,是针对药品在生产及流通过程中的状态监管,然而这一系统却因电子监管码设备的高昂价格和数据安全问题于2016年“寿终正寝”。
而由药企自身建立药品追溯信息系统更是存在不小难度。嘉事堂药业股份有限公司副总裁薛翠平表示:“像我们这样的商业企业,面向几千家药企,要跟每家平台对接是不现实的。”
医药零售行业资深人士邱和东认为,药品追溯是正确方向,也是加强食品药品监督的有效方式,将药品追溯体系建设具体落实到企业和第三方层面,既能减少不必要的行政成本,还能促进市场监管体制创新。然而最大的弊端则是会容易出现监管漏洞,追溯数据闭塞,这也是需要各方共同努力完善的地方。
此次发布的《指导意见》鼓励信息技术企业作为第三方技术机构,为药品上市许可持有人、生产企业、经营企业、使用单位提供药品追溯信息技术服务。而在“疫苗事件”中,第三方追溯平台也崭露头角。阿里健康、搜狗搜索、百度、腾讯、丁香园等平台,都相继推出问题疫苗查询业务。
成本、风险难控
《指导意见》删除了《国家药监局关于药品信息化追溯体系建设的指导意见(征求意见稿)》中“2022年底基本完成药品信息化追溯体系全覆盖的建设目标”的内容,而追溯推进的时间表正是药品追溯系统落地的关键问题之一。
同时,尽管《指导意见》明确了企业作为追溯责任的主体,并且鼓励第三方平台为企业提供药品追溯信息技术服务。但是对于企业来说,不仅要支付硬件设施如电脑、扫码设备、加密设备等费用,还需支付软件开发和后期维护以及聘请相关专业人员的费用,这就意味着企业的成本将不可避免的增加。
第三方建立追溯协同平台也同样存在风险。“谁来对第三方平台进行认证?对接那么多企业信息,会不会存在泄密的风险?”哈药集团信息技术部部长何健民表示,对第三方平台的定位和建设必须进行完备的考量。
根据早前下发的《药品追溯编码要求》,药品上市许可持有人应根据编码对象选择符合本标准要求的具体编码规则进行编码。对此,业内有专家表示,这意味着未来的药品追溯行业会多码并存,但也建议,在药品追溯体系建设中,国家层面应统一编码标准,并且与国际接轨,使用GS1标准。
中国化学制药工业协会副会长张明禹指出,我国的医药企业总有一天要走到全球的医药市场上,去和外国企业竞争,因此,我国的药品追溯标准一方面要和国际接轨,要防止“国外不认”,同时要为中国企业争取国际话语权。据北京嘉华汇成科技股份有限公司市场部国际事务主管霍然介绍:“目前已经有40多个国家和地区发布药品追溯法案,对在他们国内销售的药品进行全程跟踪,保障药品质量。我国销往这些国家和地区的药品也在监控范围内。”